喷雾冷却具有散热能力强、冷却工质需求量小等优点,在解决电子器件散热方面具有广阔的应用前景。纯水中添加醇类可以有效提升喷雾冷却性能。为进一步探索醇类添加剂强化喷雾冷却性能的机理,本文开展醇水混合溶液表面张力和接触角的实验测定研究。分别在水中加入不同浓度的乙醇、正丙醇、正丁醇、正戊醇、正己醇、正庚醇和正辛醇等醇类,利用悬滴法探究醇类浓度对溶液的表面张力的影响规律;利用Young-Laplace坐滴法探究醇类浓度对接触角的影响规律。结果表明,水中添加醇类后表面张力降低,且其随醇类溶质浓度的增加而变小,且其下降速率均随浓度的增加越来越慢;添加低醇类添加剂均可降低溶液的接触角,而高醇类接触角随浓度变化没有明显的变化规律。
21世纪是电子的世纪,电子元件的热流密度也随着其先进性逐步提升。当前最高端的处理器的发热热流密度高达250 W·cm-2[1]。为了避免电子设备高温引起故障,电子元件的冷却问题变得非常重要。
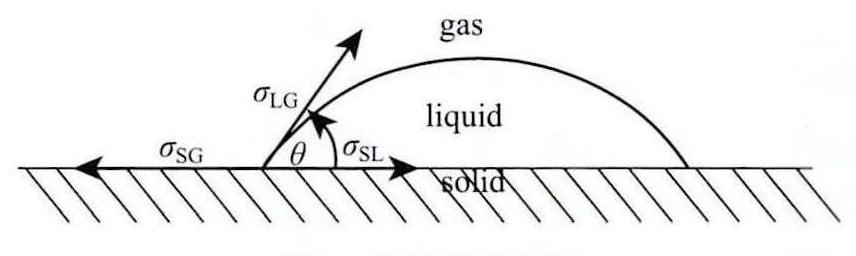
喷雾冷却具有散热能力强、冷却工质需求量小等优点,在解决电子器件散热方面具有广阔的应用前景。而在喷雾冷却的研究方向中,研究人员致力于使用添加剂如油,纳米粒子,盐类,表面活性剂和醇类等提高纯物质的传热速率[2]。使用添加剂的主要想法是通过改变冷却剂的物理特性来增强喷射在固体表面上的喷雾的扩散和蒸发速率[3]。王磊[4]在水中添加SDS后并用其水溶液进行喷雾冷却实验,发现溶液换热性能提高。Satya V R等[5]在水中添加Tween 20添加剂,并用其进行喷雾冷却,发现冷却率大大增强。还有研究表明,降低液体表面张力可以使气泡成核临界半径变小,从而增多了气泡成核位点。Chandra S等[6]发现,添加阴离子表面活性剂如十二烷基硫酸钠会增强喷雾冷却的传热速率。观察到液滴与固体表面之间接触角的减小会促进液体铺展性,这增加了热传递速率,也使得液滴的蒸发速率变高。此外,Carel J V O[7]研究表明减小接触角可以提高蒸发速率。Sean P R等[8]发现表面张力的减小导致接触角减小,液滴润湿性变好。
可见,液滴的表面张力和接触角对于提高传热过程中的传热速率方面具有很重要的作用。因此,本文对乙醇,正丙醇,正丁醇,正戊醇,正己醇,正庚醇和正辛醇与水不同比例掺混后的表面张力和接触角的变化进行更详细的研究,以探索醇类添加剂强化喷雾冷却性能的机理。
1 实验介绍
本文在25℃的环境温度下,采用前文所述7种醇类与水掺混,测量其表面张力以及其与光滑紫铜金属表面的接触角。探究混合溶液表面张力以及接触角随醇类浓度的变化规律。
根据醇类在水中的溶解度选取的各醇类实验浓度表1所示。实验使用的水是过滤纯净水,表面张力为72 mN/m(25℃)。配制所用仪器有精密电子天平,烧杯,移液枪。配置好的溶液用玻璃棒搅拌使其混合均匀,然后取适量于试管内,装上瓶塞贴标签待用。
表1 实验条件
1.1 表面张力测定原理
表面张力的形成机理为:表面层内的液体分子受到内侧和外侧的液体分子互吸力不平衡,内侧的吸力大于外侧的吸力。因此表面层分子受到一垂直液面向内的合引力。由于合引力的存在,表面层分子比液体内部分子有较高的势能,表面层势能有减小的趋势,使得表面有收缩的趋势。
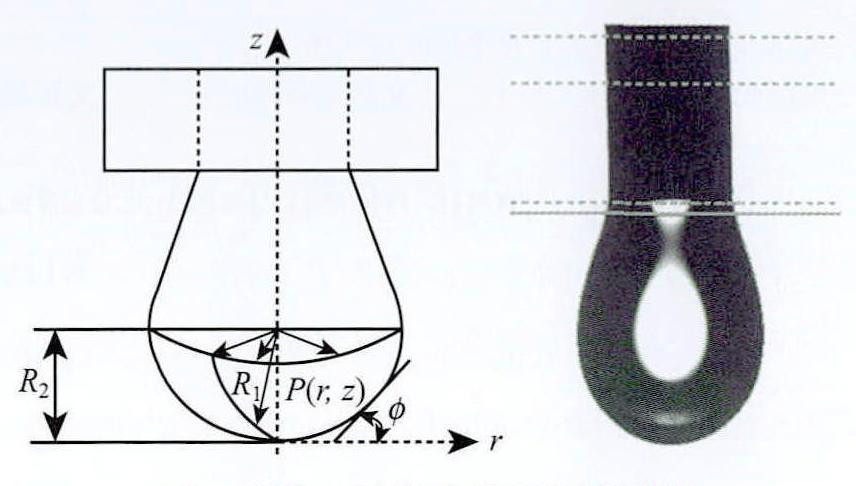
在本研究中,采用悬滴法(PDM)测量表面张力。随着数字图像处理技术的发展,PDM已成为高可靠性,易操作的最常用方法。假设当悬滴从气针中的针悬挂下来时。液滴的形状取决于表面张力和重力之间的关系。因此,使用液滴形状分析可以从液滴图像中确定表面张力。图1所示为悬滴法表面张力的示意图。
图1 悬滴法测量原理图及液滴形状
Fig.1 PDM measurement
根据图1有:
其中,β为直接取决于液滴形状的形状参数,R1为液滴表面上点P处的主曲率半径,R2为液滴顶点处的曲率半径,Φ为r轴与点P的切线之间的夹角,Δρ为试验液体和环境气体之间的密度差,g为重力加速度,K为毛细常数,σ为表面张力。
1.2 表面张力测定实验流程
在实验中,悬垂液滴的数据由采集系统记录,由图像分析系统将获得的形状数字化。然后使用不同算法分析数字信号以确定表面张力。表2为实验装置的细节。通过平均重复测量以保证测量精度。
表2 实验装置
Table 2 Experimental equipment
表格图1.3 接触角测定原理
接触角是指在气、液、固三相交点处所作的液气界面的切线,此切线在液体一侧的与固液交界线之间的夹角θ,是润湿程度的量度[9]。
对于液体润湿固体表面,存在两种现象:第一种为液体完全润湿固体表面,此时液气界面与固液界面被完全隔离开,因此不存在气、液、固三相交点,接触角夹角为0°;另一种情况为,液体的润湿性不足够好,只能部分润湿固体表面,此时就会存在气、液、固三相交点,此时接触角非零。如图2所示,此时的三相点处的表面张力满足Young-Laplace方程:
其中,σLG为液气界面张力,σSG为固气界面张力,σSL为固液界面张力,θ为接触角。
图2 接触角示意图
Fig.2 Diagram of contact angle
接触角的增加意味着液体在固体表面润湿性变差,液体不易于在固体表面铺展,液体和固体表面的接触面减小,由于固体与气体之间的传热速度要明显低于固体与液体之间的传热速度,因此固体表面更易出现干涸现象,传热效果会明显变差。
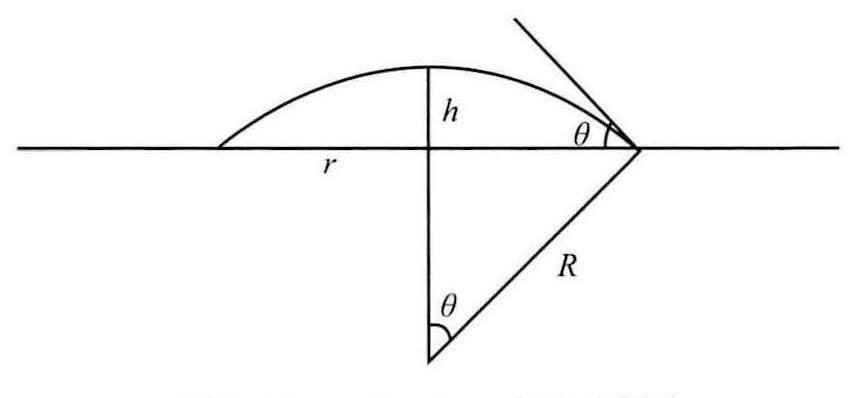
本实验运用Young-Laplace方法进行接触角的测量,如图3所示:
图3 Young-Laplace方法示意图
Fig.3 Diagram of the Young-Laplace method
其中,r为液滴基底的半径,h为液滴高度,R为液滴曲率半径。通过测量液滴与固体表面的底部接触直径与液滴的高度,从而计算出液滴与固体表面的接触角。
1.4 接触角测定实验流程
本实验在环境温度25℃、环境压力105Pa下进行。用直径为0.5 mm的注射器从试管中吸取适量配置好的溶液置于卡座上后,调整针头竖直,调整焦距使成像清晰。然后将紫铜金属表面置于针管正下方,被测液体从注射器中缓慢的、自动的从注射器中被滴至紫铜表面,液体形状稳定后,测量直径,然后利用Young-Laplace法计算出接触角。为减少测量误差,移动金属片,使液滴落于金属片的9个不同位置再进行接触角的测量,并重复实验10次。对测量得到的结果取平均值,作为被测液体与紫铜金属面的接触角的最终结果。
图4为实验系统。其中,1为注射器,2为平行光源,3为镜头,4为待测液滴,5为支座。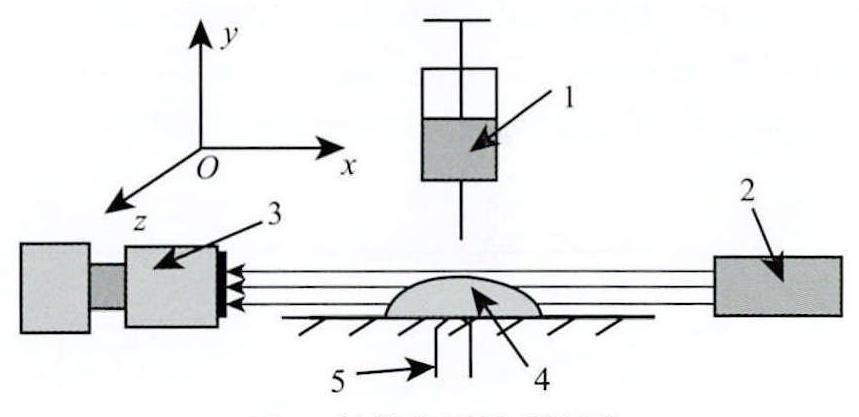
图4 接触角测量系统图
Fig.4 Diagram of contact angle measurement system
2 添加剂对表面张力的影响
乙醇,正丙醇,正丁醇与水的混合溶液的表面张力与质量分数的关系如图5所示。三种溶液表面张力均随溶质浓度的增加而降低,且降低速率随浓度增大而渐渐缓慢。其中,乙醇在质量分数ω=0.9时,表面张力最低达24.9 mN/m,下降幅度65.42%;正丙醇表面张力在质量分数ω=0.9时降至23.3 mN/m,下降比例67.64%;正丁醇在质量分数ω=0.07时,表面张力为30.8 mN/m,降低幅度57.22%。在溶解度范围内,当取相同的溶质浓度时,表面张力从小到大的排序为正丁醇,正丙醇,乙醇。
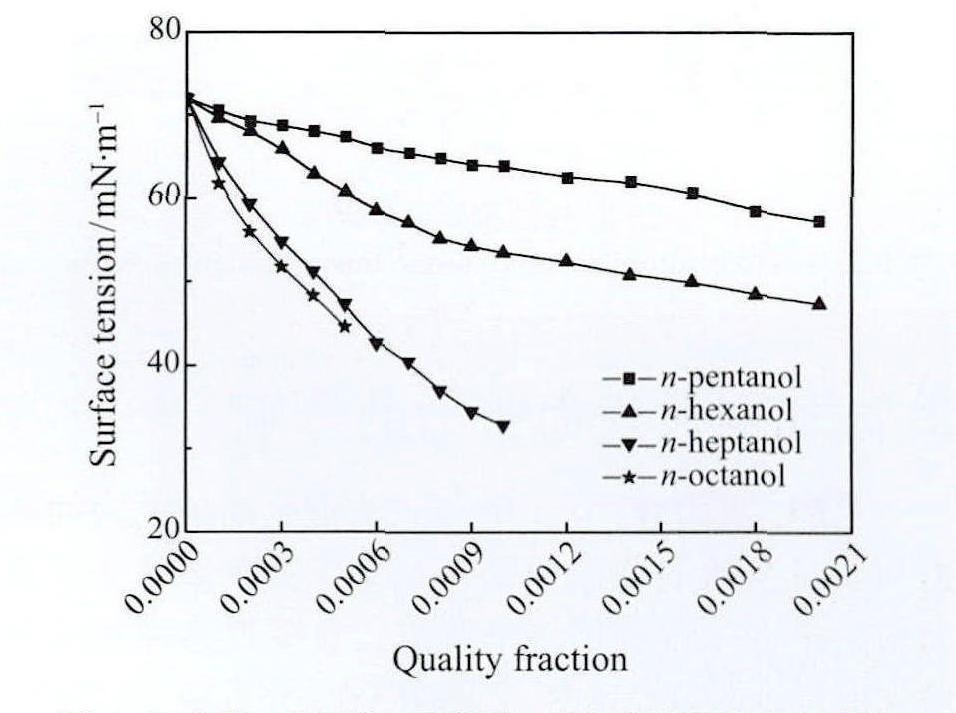
正戊醇、正己醇、正庚醇、正辛醇的表面张力随质量分数的变化趋势如图6所示。四种溶液的表面张力均随着溶质浓度的增加而减小,且表面张力的下降速度均随浓度的增加而渐缓。纯水的表面张力为72 mN/m,因此添加四种醇类均可在不同程度上降低表面张力。其中,正戊醇表面张力最小值可达57.3 mN/m,下降幅度20.42%;正己醇在质量分数ω=0.002时表面张力约为47.5 mN/m,下降幅度34.03%。正庚醇在ω=0.002时表面张力低至32.9mN/m,下降幅度54.31%;正辛醇在ω=0.0005时表面张力为44.6 mN/m,降低幅度38.06%。在溶解度范围内,取相同浓度的不同溶液,表面张力从小到大排序正庚醇,正辛醇,正己醇,正戊醇。
图5 乙醇、正丙醇、正丁醇表面张力与质量分数的关系
Fig.5 Relationship between surface tension and quality fraction of ethanol,n-propanol and n-butanol
图6 正戊醇、正己醇、正庚醇、正辛醇表面张力与质量分数的关系
Fig.6 Relationship between surface tension and quality frac-tion of n-pentanol,n-hexanol,n-heptanol and n-octanol
添加醇类可以降低混合溶液的表面张力,这是由于醇类的加入改变了原本水分子间的分子排列结构。纯水中分子间通过氢键连接,这样的排列使得水的氢键形成了网状结构。在水中添加醇类后,由于醇类具有两亲结构,一端是表现亲水性的羟基,一段为具有疏水性的烷基,因此当羟基与水分子之间形成了氢键后,另一端的烷基便会打破原先水表面氢键的分布,使得氢键的极性增加。为了保证氢键的数目,也为了减小斥力,水的氢键网发生重排,水分子有序的形成笼状排列—十二面体水笼,将烷基包裹起来。这些多面体能发生缔合,构成一种球形点阵。这就导致分子间不再是氢键网结构,而是形成一个一个的水笼体,水笼体之间以范德华力相互作用。而范德华的作用力小于氢键,因此分子间的作用力变小,表面张力减小。
根据液滴的破碎机理[10],液滴形变存在公式:
其中,ρg为气体密度,ud为气液速度差,d为液滴直径,σ为液滴表面张力大小,We为韦伯数。
可见,空气动力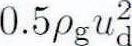 与液体直径与表面张力之比d/σ成反比。液滴的破碎条件为:We>Web,即临界韦伯数。因此可知,表面张力越小,We越大,液体越容易破碎,使其化为更小直径的液滴,这样就使得液滴密度变大,可携带的气泡数量增多,从而强化核态沸腾时的传热效果。
与液体直径与表面张力之比d/σ成反比。液滴的破碎条件为:We>Web,即临界韦伯数。因此可知,表面张力越小,We越大,液体越容易破碎,使其化为更小直径的液滴,这样就使得液滴密度变大,可携带的气泡数量增多,从而强化核态沸腾时的传热效果。
3 添加剂对接触角的影响
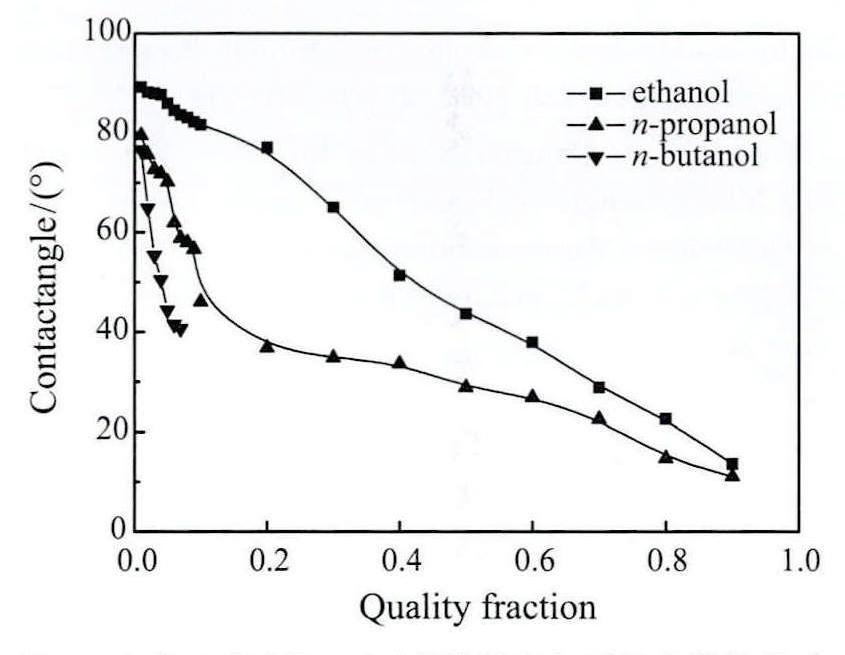
对实验过程中的接触角进行拍照,液滴图像如图7所示。乙醇、正丙醇和正丁醇的接触角随质量分数的变化关系如图8所示。可见添加三种醇类后接触角均随溶质浓度的增加而减小。乙醇在质量分数ω=0.01时接触角最大,为80.4°,接触角随着浓度的增大而降低,接触角最小达23.1°,下降幅度71.27%;正丙醇在质置分数ω=0.01时接触角为77.6°,质量分数ω=0.9时最小,为14.7°,下降幅度81.06%。正丁醇接触角最大为76.6°,质量分数ω=0.07时降至40.6°,下降幅度47.00%。纯水在环境温度25°下的测试接触角85.5°,可见添加三种醇类均可不同程度地降低接触角。取相同浓度时,接触角从小到大为正丁醇,正丙醇,乙醇。
图7 接触角测量图像
Fig.7 Image of contact angle measurement
图8 乙醇、正丙醇、正丁醇接触角与质量分数的关系
Fig.8 Relationship between contact angle and quality fraction of ethanol,n-propanol and n-butanol
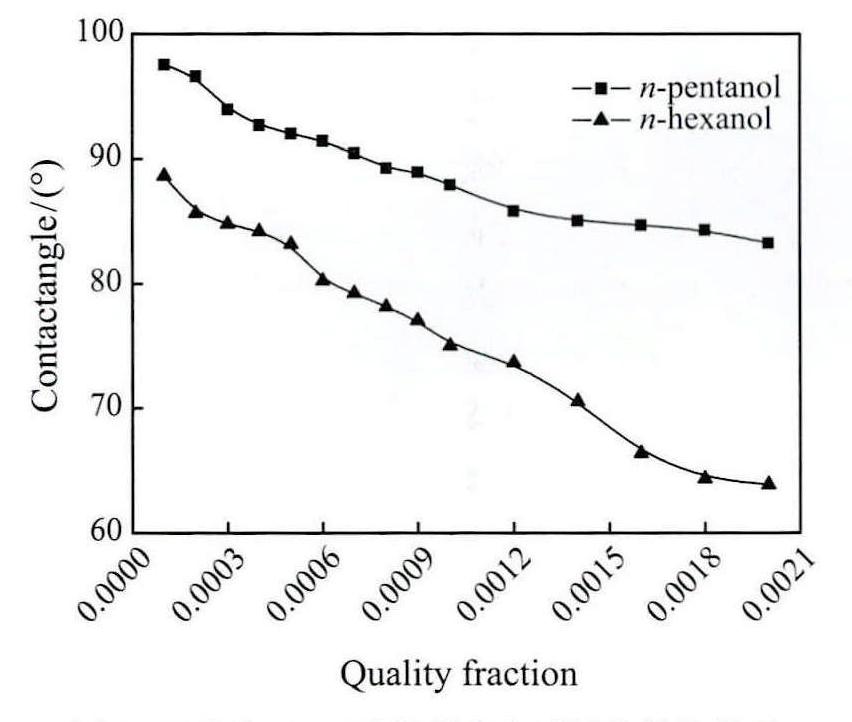
正戊醇、正己醇接触角与质量分数的关系如图9所示。水溶液接触角随浓度增加呈现出下降的规律。正戊醇最大值为97.5°,下降至最小值为83.3°。可见对于正戊醇,其水溶液没有降低接触角。正己醇最大值为88.7°,当质量分数ω=0.002时,接触角下降至最小值为65.9°。可见正己醇的添加可在一定程度上降低接触角。
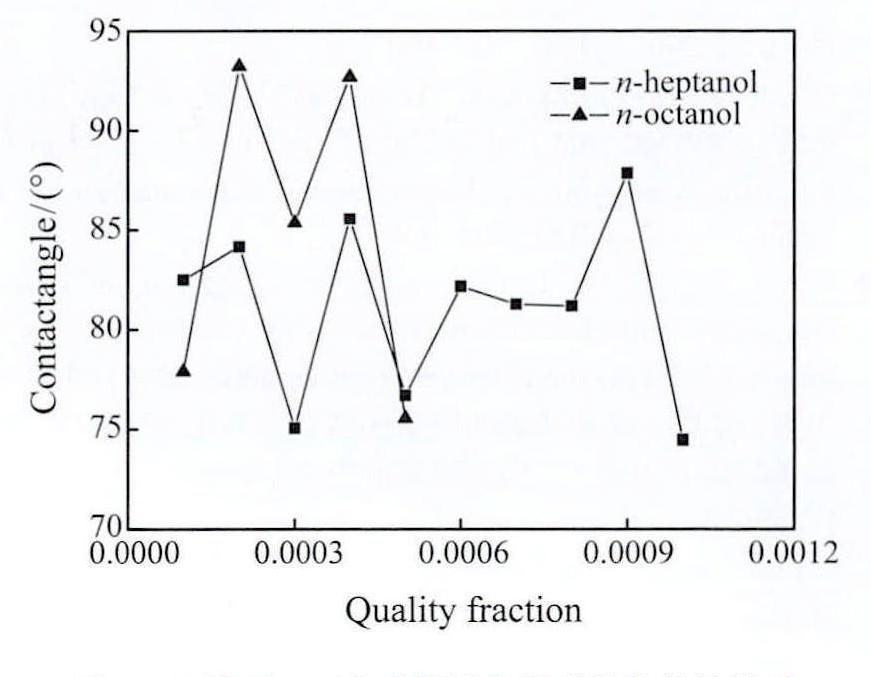
正庚醇,正辛醇两种溶解度极低的醇类的接触角与质量分数的关系如图10所示,可知其接触角不随浓度增加呈现出明显的变化规律。对于正辛醇,其与水混合后,接触角在75°~95°之间波动。对于正庚醇,其接触角于74°~86°间跳动,因此正辛醇和正庚醇的添加并没有明显降低接触角。这是由于正辛醇和正庚醇的水溶解度过小,因此虽然经过充分混合,但是溶质分布依然不足够均匀,因此在测量接触角时数值出现振荡。
图9 正戊醇、正己醇接触角与质量分数的关系
Fig.9 Relationship between contact angle and quality fraction of n-pentanol and n-hexanol
图1 0 正庚醇、正辛醇接触角与质量分数的关系
Fig.10 Relationship between contact angle and quality fraction of n-heptanol and n-octanol
在水中添加低醇类会降低表面张力。而这种表面张力的降低导致了液体的快速扩散,使液-汽界面与固体表面接触角的减小,液体润湿固体表面的能力增加。
4 结论
本文对于添加了不同添加剂的溶液的表面张力和接触角进行了测试和分析,可以得出以下结论:
1)水中添加醇类后均会降低溶液的表面张力,表面张力均随着溶质质量分数的增加而变小,并且表面张力下降速率均随浓度的增加越来越慢。
不论对于溶解度较高的醇(乙醇,正丙醇,正丁醇)还是溶解度较低的醇(正戊醇,正己醇,正庚醇,正辛醇),在溶解度范围内,质量分数相同时,醇类的表面张力随碳原子数增加而降低。
2)添加乙醇、正丙醇、正丁醇和正己醇均可降低纯水的接触角,且这四种醇类接触角均随溶质质量分数的增加而减小。对于溶解度较高的醇(乙醇,正丙醇,正丁醇),在溶解度范围内,质量分数相同时,接触角从小到大为正丁醇,正丙醇,乙醇。
3)添加正戊醇、正庚醇和正辛醇没有降低工质在紫铜表面的接触角,其中正戊醇接触角随溶质质量分数的增加而减小;而对于正庚醇和正辛醇两种溶解度极低的醇类,其接触角不随质量分数增加呈现出明显的变化规律。

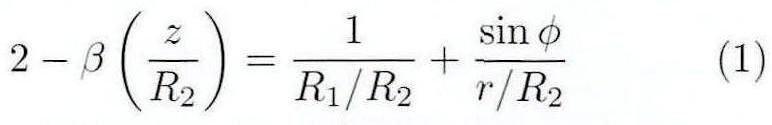
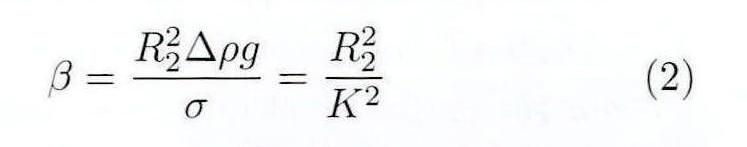
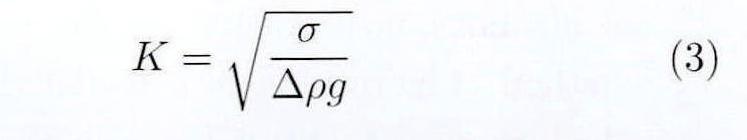

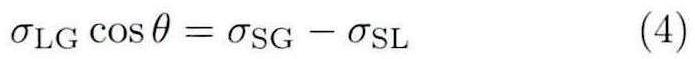


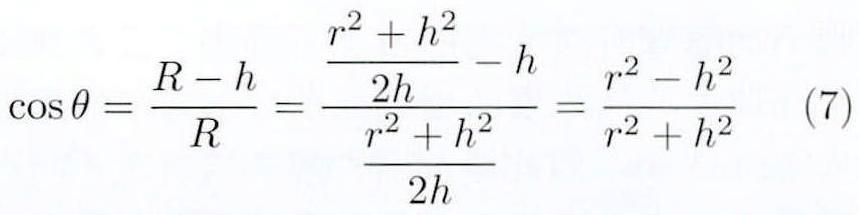



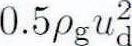 与液体直径与表面张力之比d/σ成反比。液滴的破碎条件为:We>Web,即临界韦伯数。因此可知,表面张力越小,We越大,液体越容易破碎,使其化为更小直径的液滴,这样就使得液滴密度变大,可携带的气泡数量增多,从而强化核态沸腾时的传热效果。
与液体直径与表面张力之比d/σ成反比。液滴的破碎条件为:We>Web,即临界韦伯数。因此可知,表面张力越小,We越大,液体越容易破碎,使其化为更小直径的液滴,这样就使得液滴密度变大,可携带的气泡数量增多,从而强化核态沸腾时的传热效果。